单倍型与从尼安德特人遗传的严重Covid发生率较低相关
由SvantePääbo,2021年1月22日贡献(发送给2020年12月21日,审阅; Tobias L. Lenz和Lluis Quintana-Murci审阅)
最近显示,与重症急性呼吸综合征冠状病毒2(SARS-CoV-2)感染时感染COVID-19病重相关的主要遗传危险因素是从尼安德特人遗传的。现在,新的,更大的遗传关联研究允许发现其他遗传风险因素。使用来自重症监护病态遗传学(GenOMICC)联盟的数据,我们显示12号染色体上与感染重症监护有关的区域的单倍型是从尼安德特人遗传的。该区域编码激活RNA病毒感染过程中重要酶的蛋白质。与先前描述的尼安德特人单倍型增加了发生严重COVID-19的风险相反,该尼安德特人的单倍型对严重疾病具有保护作用。它也不同于风险单倍型,因为它的作用更为温和,并且在非洲以外的世界所有地区都以很高的频率发生。在欧亚大陆西部的古代人类基因组中,尼安德特人保护性单倍体的频率可能在20,000到10,000年前增加了,在过去的1,000 y期间又增加了。
尼安德特人大约在一百万年前在欧亚大陆西部进化,并随后在很大程度上与非洲现代人类的祖先分开生活(1),尽管很可能发生了来自非洲的有限基因流动(2-5)。尼安德特人以及他们的亚洲姊妹团体丹尼索瓦人(Denisovans)大约在40,000年前就灭绝了(6)。然而,它们通过对现代人口的遗传贡献而继续对当今的人类生理产生生物学影响,而现代贡献是在其存在的最后几万年间发生的(例如,参考文献7-10)。
这些贡献中的一些可能反映了对尼安德特人居住了数十万年的非洲以外环境的适应(11)。在这段时间内,他们很可能已经适应了传染病,而传染病是很强的选择性因素,在撒哈拉以南非洲地区和欧亚大陆之间可能至少部分不同(12)。确实,已经证明了古人类素对现代人类的几种遗传变异会影响涉及免疫的基因(例如,参考文献7、8、13、14)。特别地,尼安德特人和Denisovans(15)来自几个包含与先天免疫有关的基因的基因座的变体,例如toll样受体基因变体,它们降低了对幽门螺杆菌感染的易感性和过敏风险(16)。此外,与RNA病毒相互作用的蛋白质已显示出比预期的更多地由尼安德特人(Neandertals)渗入的DNA区域编码(17),而RNA病毒可能已导致人类发生许多适应性事件(18)。
最近,有研究表明,第3号染色体区域的单倍型与新型严重急性呼吸道冠状病毒2(SARS-CoV-2)感染时危重症有关(19),并由尼安德特人(Neandertals)促成现代人类(20 )。该单倍型的每个副本在被SARS-CoV-2感染时,其携带者需要重症监护的风险大约翻倍。在南亚,它的载波频率高达〜65%,在欧洲,它的频率高达〜16%,而在东亚则几乎不存在。因此,尽管这种单倍型在当前的大流行中对其携带者有害,但它可能在南亚的早期曾是有益的(21),可能是通过提供了对其他病原体的保护作用,而在东亚,通过负选择已被消除了。 。
重症监护病死遗传学(GenOMICC)财团的一项新研究包括2244名重症COVID-19患者和对照组(22),最近可用。除了3号染色体上的风险位点外,它还鉴定了位于染色体6、12、19和21上具有全基因组显着影响的7个基因座。 SARS-CoV-2感染后患重病的原因来自尼安德特人。
我们调查了索引单核苷酸多态性(SNP),即与关联性最强的SNP(材料和方法)是否位于与需要在染色体6上感染SARS-CoV-2时需要加强监护的7个基因座相关的风险, 12、19和21(22)带有尼安德特人的等位基因。为此,我们要求索引SNP的等位基因之一应与所有三个高质量尼安德特人基因组匹配,而在108个非洲约鲁巴人的基因组中不存在[r 2> n。 0.80; 1000基因组计划(23)]。 6号,19号和21号染色体上的基因座的索引SNP均不满足这些标准,而12号染色体上的基因座则符合。
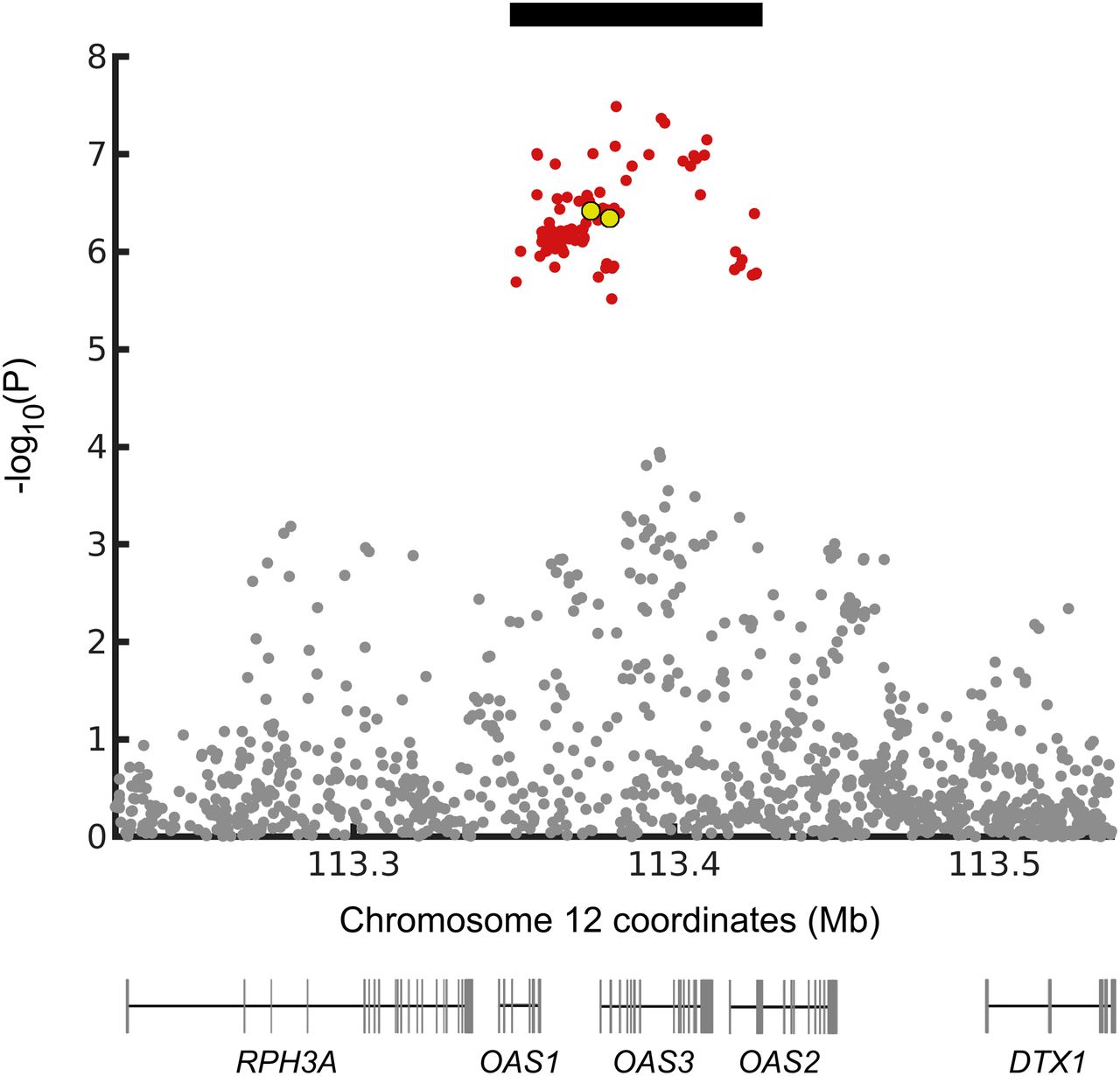
为了进一步研究该基因座,我们使用了来自COVID-19宿主遗传学计划[HGI;第4轮(24)]。我们发现在欧洲人中,与COVID-19住院相关的12号染色体位点的SNP(P <1.0e-5;图1)在连锁不平衡(LD)中(r 2≥0.8),并形成单倍型75 kb(chr12:113,350,796至113,425,679; hg19)。在SI附录表S1中给出了GenOMICC研究的SNP指数的LD。由于与尼安德特人的杂交,在约鲁巴语中没有这种长度的等位基因的单倍型存在于尼安德特人中,但很可能已被引入现代人类的基因库中(25)。
为了测试75 kb的单倍型是否是尼安德特人的基因流动的结果,我们分析了其与当今和古朴基因组的关系。为此,我们使用了1000个基因组计划(23)中个体中观察到的单倍型10倍以上,以及西伯利亚南部Chagyrskaya Cave约70,000岁尼安德特人的基因组序列(26),约50,000来自克罗地亚Vindija洞穴的y尼安德特人(27),来自西伯利亚南部Denisova洞穴的约120,000 y的尼安德特人(1)和来自同一地点的约80,000 y的Denisovan个人(28)。图2显示了一个系统发育树,估计了这些单倍型之间的关系。在64种现代人类单倍型中,有8种与三个尼安德特人序列组成一个单系群。
与尼安德特人基因组相似的基因组片段可能来自生活在大约一百万年前的这两组人的共同祖先,或者是尼安德特人通过在两人在不到十年前相遇时在两者之间混合而为现代人类做出的贡献(25) 。为了测试自各组的共同祖先以来75 kb的片段是否可能在基因组的这一区域中幸存而没有被影响每一代染色体的重组所破坏,我们使用已发表的等式(29),即29岁(30),区域重组率为0.80 cM / Mb(31),尼安德特人和现代人类之间的分裂时间为550,000 y(1),随后约50,000 y杂交。根据这些假设,在该区域中,预计不会从尼安德特人和现代人类的祖先群体中衍生出长度为16.3 kb或更长的片段(P = 0.05),因此75 kb的单倍型极不可能这样做(P = 8.2e-9)。因此,我们得出的结论是,单倍型从尼安德特人进入了人类基因库。与此一致的是,先前的研究(32)描述了尼安德特人在该基因组区域的基因流动。
我们发现GenOMICC研究中保护性单倍型的索引变体(rs10735079,P = 1.7e-8)与所有可用的三个尼安德特人基因组匹配。每份尼安德特人单倍型需要重症监护的相对风险降低约22%(在罕见病假设下,优势比[OR] = 0.78,95%CI 0.71至0.85)。如系统发育所预期的那样(图2),几乎所有与SNP指数的保护性等位基因共分离的等位基因都在尼安德特人基因组中找到(35个中的34个称为SNP);参见SI附录,表S2,与图1包括23andMe对HGI贡献的数据。
如今,在撒哈拉以南的非洲人口中几乎没有单倍型,但在欧亚大陆的大多数人口中,单倍型的存在频率约为25%至30%(图3)。在美洲,它在某些非洲血统的种群中以较低的频率发生,大概是由于欧洲或美洲印第安血统的种群的基因流所致(33)。
防止在12号染色体上出现严重COVID-19的尼安德特人单倍型包含编码寡聚腺苷酸合成酶的三个基因OAS1,OAS2和OAS3的部分或全部。这些酶被干扰素诱导并被双链RNA激活。它们产生短链聚腺苷酸,然后激活核糖核酸酶L,该酶可降解细胞内双链RNA,并激活被病毒感染的细胞中的其他抗病毒机制(参见参考文献34)。
为了研究这些基因中的哪些可能参与针对严重COVID-19的保护,我们绘制了与严重COVID-19相关的SNP的P值以下的OAS基因的基因组位置(图1)。尽管关联(P <1.0e-5)与所有三个OAS基因重叠,但是具有最显着关联(P <5.0e-8)的SNP在OAS3中。但是,关联中较高的LD和随机性可得出基于P值脆弱的因果关系的任何结论。
Warning: Can only detect less than 5000 characters
我们提醒您,可用的史前数据严重偏向欧亚大陆西部,并且仍然稀疏,尤其是在较早时期。但是,来自古代人类遗体的其他数据正在迅速生成,这使我们充满信心,通过研究某些地理区域中随着时间推移的等位基因频率,并进行校正,可以很快识别出可能成为阳性和阴性选择目标的基因座。导致等位基因频率发生全基因组转移的迁移事件。
尽管有这些警告,但有趣的是,最近从欧亚大陆获得的尼安德特人(Nanderander)衍生的OAS基因座的频率有所增加。这与以前关于当今人群变异的研究(32、35、43)是一致的,表明该基因座已被积极选择。它也与Denisovans兼容,它提供了该基因座的一个版本,例如在切片受体位点(rs10774671)上对大洋洲的人们带有祖先变体,如今这里发生的频率很高(44)。
在目前的SARS-CoV-2大流行中,第12号染色体上的尼安德特人单倍型可保护严重疾病。它存在于欧亚大陆和美洲的人口中,其载波频率经常达到并超过50%。因此,祖先的尼安德特人OAS基因座变体可能对整个欧亚大陆的现代人类都是有利的,这可能是由于一种或多种涉及RNA病毒的流行病,特别是考虑到尼安德特人的单倍型已发现对至少三种RNA病毒具有保护作用(西尼罗河病毒) ,丙型肝炎病毒,SARS-CoV)。支持这一观点的模拟表明,尼安德特人的OAS单倍型已经在现代人类中得到积极选择(35)。引人注目的是,现代人OAS单倍型编码的OAS1蛋白的酶活性比尼安德特人单倍型编码的酶低(37)。在非洲的某个地方,这可能是有利的,因为在灵长类动物中,OAS1基因座的功能丧失突变已发生过多次(45),这表明维持OAS1活性对生物体而言是昂贵的。可以推测,当现代人类在非洲以外遇到新的RNA病毒时,他们通过与尼安德特人的遗传相互作用获得的祖先变体更高的酶促活性可能是有利的。
有趣的是,有证据表明,类似尼安德特人的OAS单倍体在欧亚大陆的频率最近有所增加(图4 A),这表明选择可能在最近一千年中对尼安德特人的OAS基因座产生了积极影响。从历史上对人类遗体的未来研究将阐明这种情况是否以及何时发生。
从GenOMICC(22)获得了七个新基因座(rs9380142,rs143334143,rs3131294,rs10735079,rs74956615,rs2109069和rs2236757)的索引变体。使用COVID-19 HGI(24)(https://covid19hg.org/results)进行的荟萃分析第4轮发布的区域摘要统计数据来分析12号染色体位点(住院与人口对照,即,“ B2”表型,使用所有祖先,但不包括23andMe研究,因为变体数量有限。使用LDlink 4.1计算LD,并使用tabix(HTSlib 1.10)将等位基因与古基因组进行比较。使用系统进化软件(PhyML 3.0)研究了与针对严重COVID-19的保护相关的单倍型,并根据所述方法计算了观察到一定长度或更长时间的单倍型的可能性,该单倍型是由于谱系分选不完整而导致的(29)。通过在chr12区域中包括113,350,796至113,425,679(不包括单身人士)在内的所有可变位置来构建当前的单倍型。系统发育分析包括超过10次的单倍型。从Ensembl中获取了当今人类中可变位置的祖先状态。现代人类古代基因组的基因型是从已编译的数据库中获得的(42)。使用Mathematica 11.0(Wolfram Research,Inc.)和OpenStreetMap数据制作了显示不同人群等位基因频率的图。
我们感谢COVID-19 HGI提供了遗传关联的简要统计信息,并感谢马克斯·普朗克学会和NOMIS基金会的资助。
作者贡献:H.Z.和S.P.设计的研究;赫兹。进行研究;赫兹。分析数据;和H.Z.由S.P.撰写论文。