通过后生钟恢复视力
衰老会对我们体内的所有细胞和器官产生负面影响。我们的大脑也不例外。发育中的大脑中的神经元形成回路,可以适应受伤后的变化和再生。众所周知,这些能力会随着时间的流逝而减弱1,但构成这种恶化基础的分子转移仍然是个谜。 Lu等。图2在《自然》杂志的一篇论文中表明,可以对眼睛的神经元进行编程,使其恢复到年轻的状态,在这种状态下,它们可以重新获得抵抗损伤和再生的能力。作者的发现揭示了衰老的机理,并指出了与年龄有关的神经元疾病的有效治疗靶标。
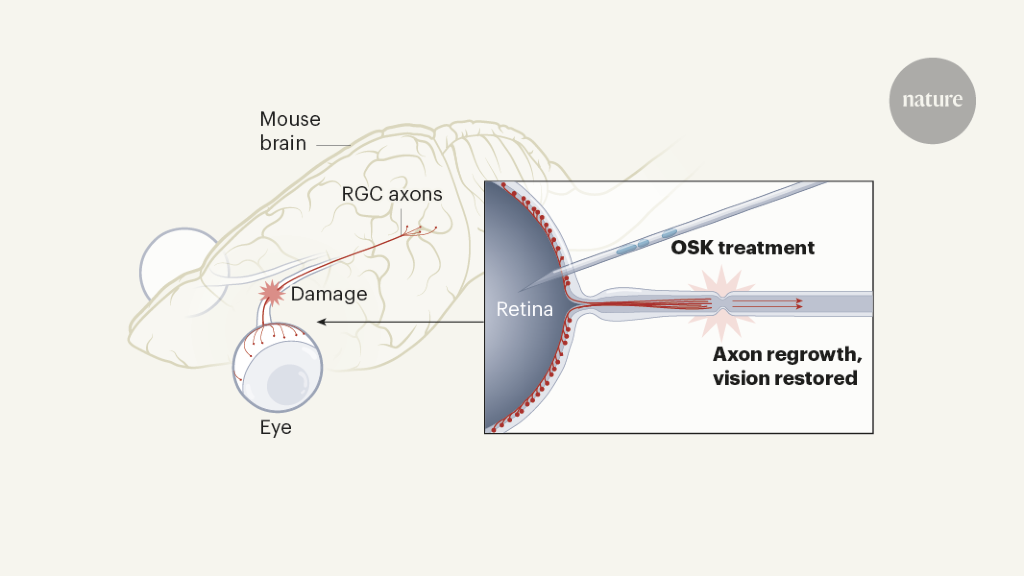
视网膜神经节细胞(RGC)驻留在眼睛中,因此位于颅骨外部,但它们是真正的大脑神经元。它们最初是前脑的一部分。随后,RGC将称为轴突的投影伸出眼睛之外,以与大脑本身的神经元建立联系。这些轴突连接在一起形成视神经,如果它们在发育早期受到破坏,则可以存活并再生,但到成熟时就不能再生3,4。证据表明3,5,这种转变是RGC固有的,而不是反映变化在周围的细胞中。
无数的研究已经寻找可以预防或促进RGC存活和再生的因素。已经发现了一些这样的因素,它们可以赋予成熟的RGC一定程度的生存和再生能力,但不足以在视神经受损4后完全维持或恢复视力。
Lu等。询问是否有可能将RGC还原为年轻的“年龄”,以及这样做是否会使细胞再生。他们用腺相关病毒感染了小鼠的RGC。这些无害的病毒已经过基因工程改造,可以诱导三种“山中因子”的表达-一组四个转录因子(Oct4,Sox2,Klf4和c-Myc),它们可以触发成熟的细胞类型进入未成熟状态6。一种通常在体内带有危害的方法:山中因子可导致细胞采用不需要的新身份和特征,从而导致肿瘤或死亡。7幸运的是,Lu和同事发现它们可以通过仅表达Oct4,Sox2和Klf4(统称为OSK)。
作者测试了被感染的RGC在细胞轴突被压碎后的再生能力。他们发现表达OSK的病毒在视神经受损后触发了RGC再生和长距离轴突延伸(图1),而RGC身份,视网膜肿瘤的形成或其他任何不良影响均无明显改变。
OSK表达对年轻和老年小鼠的RGC轴突再生均具有有益作用。在某些情况下,再生的轴突从眼睛一直延伸到视神经as(大脑底部的位置,每只眼睛的视神经交叉到相对的大脑半球)。值得注意的是,OSK的作用在年长的动物中可见,因为RGC再生的研究通常是在相对年轻的动物中进行的,这些动物具有剩余的自然再生能力。因此,有证据表明,Lu及其同事的方法可以完全恢复成熟RGC的长距离再生能力,这是该领域的里程碑。
以前几乎所有用于增强RGC存活和轴突再生的技术都必须在视神经损伤之前进行4,这是一种与治疗技术不兼容的限制。令人兴奋的是,Lu和同事表明,即使在轴突损伤后,它们也可以在不同时间点诱导OSK表达,并且仍然可以改善RGC的存活和再生。这些影响不仅限于视神经损伤。 OSK表达还可以有效逆转青光眼(人类失明的最常见原因)小鼠模型中的RGC和视力丧失。轴突和视力丧失(但在RGC死亡之前)后,RGC中OSK的表达完全恢复了这些动物的视力。野生型老老鼠也是如此:OSK可使老老鼠恢复年轻的视力。
为什么将旧的RGC重新编程为较年轻的状态可以促进再生并恢复视力?衰老领域的一个新兴模型是,随着时间的流逝,细胞会积累表观遗传噪声,即改变基因表达模式8的分子变化,包括转录变化和DNA甲基模式的变化。总的来说,这些变化导致细胞失去其身份,从而失去曾经促进其年轻弹性9、10的DNA,RNA和蛋白质表达模式。鉴于人们越来越热衷于将DNA甲基化作为细胞年龄的标志,作者询问OSK的表达是否能以某种方式抵消衰老或轴突损伤对DNA甲基化的负面影响。
细胞蛋白质合成机的核糖体(RNA)的RNA成分由核糖体DNA基因编码,该基因随着年龄的增长会逐渐积累甲基标记。因此,核糖体的“ DNA甲基化时钟”被认为是对细胞年龄11的可靠估计。研究人员发现,损害RGC轴突的方式可以模仿核糖体DNA的加速老化,而OSK的表达可以抵消核糖体DNA甲基化的加速,这表明组织损伤通常可能是加速老化的一种形式。
该小组还测试了OSK是否需要去除DNA甲基化以再生轴突或恢复老龄小鼠的视力。 TET酶(TET1,TET2和TET3)催化DNA甲基化12的去除。作者表明OSK诱导了TET1和TET2基因的表达,降低TET1和TET2的产生阻止了OSK对RGC再生和视力恢复的影响。老老鼠。因此,DNA甲基化的变化似乎对于OSK的作用至关重要。确实,Lu等。发现OSK可以恢复涉及神经元存活,生长和连接的广泛基因中年轻的DNA甲基化模式。这些模式出现在具有高水平PRC2的染色体区域(一种在发育和衰老过程中会改变甲基化的蛋白质复合物)。13展望未来,确定OSK的正效应通过重置DNA介导的确切程度至关重要甲基化模式,以及指导细胞复位的下游机制。
陆和同事的发现可能与人类相关吗?作者发现OSK表达增强了体外人神经元的轴突再生和细胞存活。 OSK对人的作用仍有待检验,但现有结果表明OSK可能会重新编程跨物种的大脑神经元。
未来的研究还应该解决OSK表达是否可以对大脑和脊髓其他部位的神经元产生相同的显着影响。鉴于RGC是真正的大脑神经元,有充分的理由认为它们会。因此,当前的发现必将引起极大的兴奋,不仅在视力恢复领域,而且在希望了解神经元和其他细胞类型的表观遗传重编程的人们中也是如此。几十年来,一直有人认为,了解正常的神经发育过程将有一天导致修复老龄或受损大脑的工具。卢和同事的工作很清楚:那个时代已经到来。