'脑胶水'可以在严重的创伤性脑损伤后帮助恢复电路
Warning: Can only detect less than 5000 characters
Warning: Can only detect less than 5000 characters
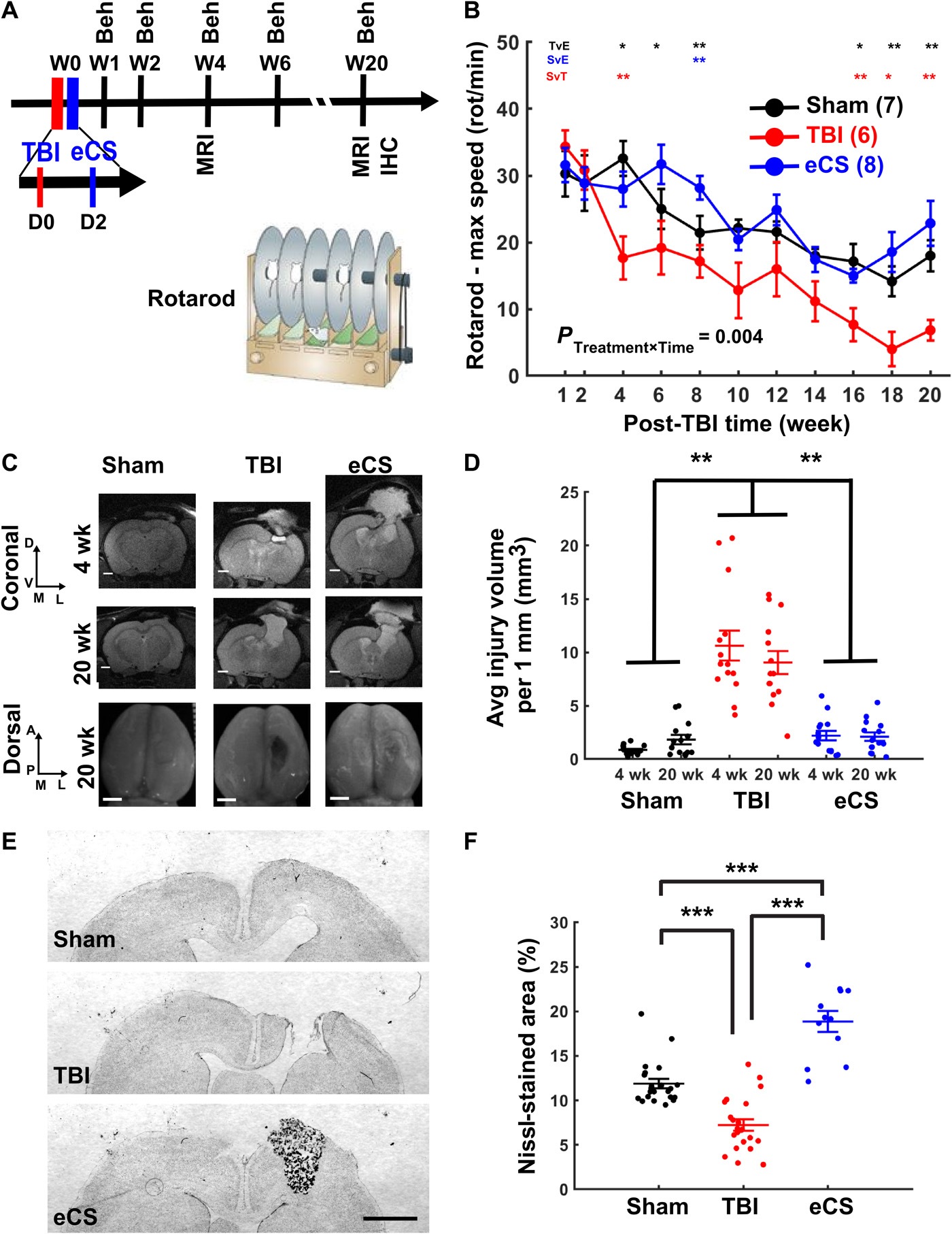
这些结果表明,尽管STBI后神经元数量显着降低,ECS基质植入物促进了细胞增殖,神经元分化,突触可塑性,以及新形成的神经元的潜在髓鞘,涉及和悬浮在内的新形成的神经元。
在STBI后,慢性炎症细胞的衰减流量可以防止延长的组织损伤和萎缩,并且是TBI(50)后的有利组织反应的标记。标志着活化巨噬细胞和反应性星形胶质细胞的慢性存在,所述活性巨噬细胞是对脑损伤的神经炎性细胞反应的特征,我们量化了CD68 +活化的巨噬细胞和胶质纤维酸性蛋白标记的(GFAP +)反应性星形胶质细胞(图S7,A至C)。我们观察到ECS基质植入大鼠具有类似的CD68 +细胞水平(图S7D)作为假对照,而TBI大鼠与假和ECS基质植入大鼠相比,CD68 +细胞的显着降低。虽然Sham和ECS大鼠显示出类似的GFAP +表达水平,但在比较中的TBI大鼠表现出GFAP +区域的显着增加(图S7E)。尽管TBI动物证明了活化巨噬细胞反应的显着降低,但是推测,与Sham对照和ECS处理的动物相比,这可能是由于TBI动物中的腹腔内组织的显着组织丧失和不存在。总体而言,这些结果表明,在STBI后20周,ECS动物中减毒神经炎细胞反应的患病率。
由于血管化不足通常对植入生物材料(51)的失败负责,因此使用胶原素IV(Col-IV +)和大鼠内皮细胞抗原(ReCa1)(Rega1)(Rega1)(Rega1)在与对照组中调查ECS基质植入动物组织新生血管的程度+)标记(图4,A和B)。我们还将CBF的MRI相位梯度成像用作血管功能的量度(图4,C至F)。
与Shem和TBI对照相比,我们发现ECS矩阵处理动物中的ReCa1 +(图S8D)和COL-IV +(图S8E)表达百分比区域的显着增加。值得注意的是,在与TBI基团相比(图4B)相比时,检测到ImA1和Col-IV聚冠状化合物在假和ECS基质处理基团中的〜60%。
因为CBF的显着减少了与STBI(52-56)的认知功能障碍和人类预后差,并且与人类和大鼠(57,58)中缺乏神经元活性和神经元体积的丧失有关(57,58)的相关性。使用基于MRI的标准化相位梯度(NPG)映射在病变中鉴定的血管(图4C)评估CBF。我们观察到ECS族植入大鼠的显着增强的总CBF(图4D和图4D;估计统计),而TBI对照动物在测量的CBF中显示出统计学上微不足道的降低。使用感兴趣的IPSI和对立区域(ROI)测量(图4E),我们检测到ECS血液植入大鼠的皮质CBF的特异性增加,其在对照与IPSILES侧检测到显着更高的CBF(图4F) 。这些结果表明,与仅TBI的控制相比,ECS基质植入大鼠表现出慢性增强的新生血管,随之而来,同时增强CBF和IPSILESINALLY。
ECS基质促进RFA中慢性前肢特异性功能恢复和活性调节的细胞骨架相关蛋白(ARC)的活化
我们使用熟练的达视任务(SRT)来研究ECS基质植入物在STBI之后的神经保护,神经源性和血管生成属性的电路特异性。 SRT被用作电动机恢复的特定于前肢的评估,然后立即通过活性调节的细胞骨架相关蛋白(ARC +)的末端体积成像。这使得可以在罗斯特尔前列区区域(RFA)中的M2到抓住区域的病变之后评估特定的任务响应。
我们发现ECS植入于SRT(图5A)培训2周的ECS植入大鼠(图5A)从与假动物相当的第2周以及长达周8(图5B和图。S10)。 TBI对照大鼠在测试的8周内显示出显着的前肢功能缺陷,瞬态改善,持续约3周(第4周至6),前8周8例明显恶化。量化IPSi和对侧ARC +神经元(ARC + / Neun +共施容;图5C)在克服到掌握活性后立即显示出前部和后射RFA区域的强烈活化和假动物中的低对侧信号(图5D)。与ECS基质植入的大鼠相比,TBI对照大鼠略微没有具有显着的对立激活的IPsilesional的RFA活性,除了相对的激活之外,在RFA病变内显示出ARC +信号。
Multunit Activity的Periles Laminar记录揭示了ECS基质植入大鼠STBI后10周的Sensimotor响应的保存
我们刺激了使用低强度电脉冲的控制爪,进一步研究ECS矩阵是否植入物直接促进感觉电流响应的恢复(图S11A)。我们使用32通道层电极评估了来自完整M1和M1 / S1区域的自发性和诱发(图S11,B和C)电生理响应(图S11D)。我们观察到,在STBI之后,对左爪的电刺激的快速响应发生在发生率并且在所有皮质层中的时间抖动而增加,并且在两个记录位置CFA和CFA / S1中增加(图S11E)。值得注意的是,响应于爪刺激的CFA区域中记录的后期响应显示出TBI动物的延迟增加(图S11E,左;平均抖动:36.5毫秒),其在ECS族植入大鼠中越快(平均值抖动:15.1毫秒)。在CFA / S1区域中未检测到这种效果(图S11E,右侧)。与预刺痛时期(图S12)相比,TBI对照大鼠还显示出在非仿真记录期间登记的持续抗刺激活性(图S12),其在假和ECS植入大鼠中未观察到。我们还发现爪子刺激诱导CFA / S1和CFA电机区域的差异激活,TBI对照动物分别证明显着的减少和ECS基质植入的动物,分别显示出明显增加的活化。这些结果表明,在TBI大鼠中,在TBI大鼠中减少了与SenselImotor函数相关的响应和激活,并在ECS基质植入大鼠中部分回收。
我们进行了脑组织清洁以具体研究血管结构是否可以揭示脉管系统特征(图6),神经元存在和行为性能之间的更强的对应关系。
在基于iMaris的脉管追踪之后(图6,A和B),我们观察到ECS大鼠中的前RFA区域显示出增加的容器段密度(图6C)和累积血管长度(图6D)与TBI相比对照大鼠,而TBI和ECS族植入的动物均显示与假(动画S1至S4)相比明显减少这些特征。我们还观察到后RFA在TBI和ECS植入动物中显示出脉管系统的密度降低。值得注意的是,只有三只大鼠中的三种大鼠在TBI对照中的RFAA ROI中存在组织存在,而所有SHAM和ECS基质植入基团中的所有动物都会显示细胞和组织存在。与TBI对照相比,组织清除和体积成像显示ECS基质植入大鼠(动画S3和S4)中的组织保存更大的组织保存倾向(图S13和电影S2),其与图1中获得的病变体积分析一致。采用强阴离子交换(SAX)高效液相色谱法
......