新冠肺炎病区SARS-CoV-2在空气中的远程传播
有证据表明,SARS-CoV-2和其他冠状病毒一样,可以通过气雾剂直接或通过通风系统传播,并有可能传播。因此,我们调查了2020年4月至5月瑞典乌普萨拉大学医院一个新冠肺炎病房和三个新冠肺炎病房排出室内空气的中央管道的通风口。拭子样本取自中央管道的各个天花板通风口和表面。随后对样本进行针对SARS-CoV-2 N和E基因的RRT-PCR。位于病房上方几层的中央通风高效空气过滤器被拆除,并以同样的方式对部分进行了分析。在随后的两次采样中,分别在19个房间通风口中的7个和4个中检测到SARS-CoV-2的N和E基因。来自病房的中央通风高效空气过滤器(HEPA)的三个样本中发现这两种基因均呈阳性。与新冠肺炎病区相邻的另外两个病区的相应滤过器也被发现呈阳性。这些样本的感染能力是通过接种敏感细胞培养物来评估的,但在这些实验中无法确定。在远离患者区域的中央通风系统中检测到SARS-CoV-2表明,病毒可以远距离传播,仅靠飞沫传播不能合理解释这一点,特别是考虑到这些病房的换气率相对较低。在采取预防措施时,必须考虑到SARS-CoV-2通过空气传播的情况。
在19型冠状病毒感染性疾病(新冠肺炎)大流行期间,飞沫传播被认为是严重急性呼吸综合征冠状病毒2型(sars-cov-2)最重要的传播途径,尽管其他传播途径,如气溶胶、粪便-口腔传播和通过混合物的间接传播可能有助于病毒1、2的全球快速传播。气溶胶和飞沫在呼吸道感染传播中的相对重要性很难区分,因为例如在说话3、4时,会产生气溶胶和飞沫大小的颗粒。能够在更远的距离和更长的时间内传输5.这一定义受到了挑战,很可能过于简单化,严格区分两个类别3、6、7可能是不稳定的。
此前,其他冠状病毒已被证明可通过气雾剂和通风系统传播,并已被确定可引起暖通空调(暖气、通风、空调)相关和医院感染,以及大范围的医院暴发疫情8、9、10、11、12、13。最近的研究表明,SARS-CoV-2在医院环境中受到广泛污染,在空气样本和隔离室14、15、16、17、18间通风口的样本中都发现了病毒RNA。此外,室内环境中感染风险的增加,以及超级传播事件,可以通过空气传播22、23、24、25、26来解释。因此,在这种情况下,了解SARS-CoV-2在有限空间中的数量以及病毒被动传播的距离是至关重要的。治疗新冠肺炎病人的病房显然既是了解空气传播的重要场所,也是研究这一现象的合适环境。在瑞典乌普萨拉大学医院新冠肺炎传染病病房,我们调查了医院大楼8(顶)层中央通风系统的隔离室通风口和过滤器中是否能检测到SARS-CoV-2RNA。由于在距离患者区域很远的地方检测到RNA,因此进行了液体样本采集,试图确定在系统中检测到的SARS-CoV-2的潜在感染能力。我们的发现可能提示SARS-CoV-2在空气中的传播和SARS-CoV-2可能通过通风气流的远距离传播。
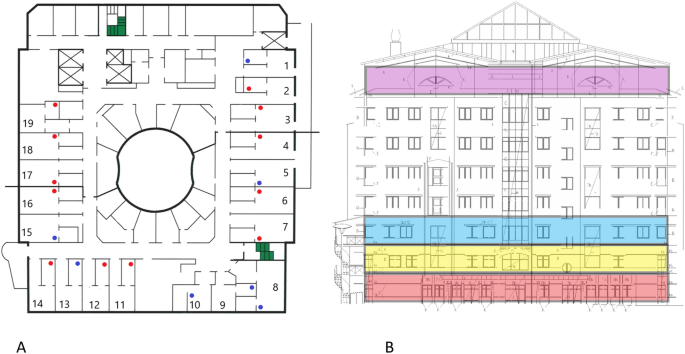
在2020年4月和5月期间,分别在不同的场合进行了采样。在前两次,4月17日和28日,对1号病房所有19个病房(图1a)的出口通风口表面进行了擦拭,如下所述。当在4月28日重复时,顶层的中央通风管道的内表面也被擦洗,过滤部分被移除,如下进一步描述。由于在通风系统中检测到SARS-CoV-2 RNA(见“结果”),在排气过滤器之前的管道末端(在4月28日采集拭子的同一区域)以及天花板通风口下进行了进一步的样本采集。
病房的所有出口通风口都位于天花板上,距离床头大约3到5米(新风输入口在地面以上0到50厘米处)。19个开口中有7个位于相邻的洗手间(见图1a),距离床位大约5到6米。病房1的每小时总换气量(ACH)在1.5到2.6之间,病房2在2.1到2.7之间,门诊在2.8到3.2之间(2017年12月测量)。每层中央通风井的风量在2.27到3.48亿立方米/秒之间(表1)。病区1房间的压力差各不相同,走廊和前厅之间的压力差为− 6~− 8.1ppa,前厅和病房间的压力差为 + 5.5%~ + 18ppa(2020年3月测量)。因此,与相邻的病房走廊和病房相比,前厅承受着负压力。
用280gμl的样品和QIAAMP病毒RNA试剂盒(德国希尔登,齐根市)按生产方案提取RNA。用RRT-PCR扩增SARS-CoV-2核衣壳(N)和包膜小膜蛋白(E)基因的一部分,使用先前描述的28、29、30引物(美国沃尔瑟姆的Thermo Fisher Science)和带有白金Taq DNA聚合酶试剂盒(Invitgen,Carlsad,CA,USA)的SuperScript III OneStep RT-PCR系统。简而言之,两种反应混合物(25μl)包括12.5gμl反应缓冲液(每个dNTP含有0.4g mm的反应缓冲液,3.2g mM的MgSO4),1gμl的酶溶液(SuperScriptIII RT/白金Taq混合物),1.25gμl的探针引物溶液(10µM的库存浓度),3gμl的硫酸镁(50g NM)和7.25gμl的RNA。循环条件为:在55℃下合成cDNA 30分钟,50℃下合成2分钟,然后在95℃变性15秒,57℃延伸30秒,在68℃采集荧光信号30秒,共45个循环。靶标1(E基因)正向引物ACAGGTACGTTAATAGTTAATAGCGT;反向引物TGTGTGCGTATACTGCTGCAGCA1,TGGGTACGTTAATAGTTAATAGCGT,TGGTTGCGTACTGCGTACTGCTGCACTGCACA1(E基因)正向引物ACAGGTACGTTAATAGTTAATAGCGT,反向引物TGTGTGCGTACTGCTGCACA.。靶基因2(N基因)正向引物GGGGAACTTCTCCTGCTAGAAT;反向引物CAGCTTGAGCAAAATGTCTG;探针5‘-FAM-TTGCTGCTGCTTGACAGATT-Tamra-3’。以E(102拷贝/µl)和N(103拷贝/µl)基因的5个核苷酸缺失的双链DNA片段(gBlock,IDT,比利时)作为阳性对照。阳性对照Ct值分别为31.67 ± 0.68和28.07 ± 2.66。所有Ct值为 <; 45的聚合酶链式反应产物均经桑格测序(荷兰马克根市)确认。阴性对照(拭子)在未暴露的VTM(支持)上进行。表1)。
将Vero E6细胞(绿色猴肾细胞ATCC CRL-1586)接种到T-25培养瓶中,在含有10%胎牛血清(美国Gibco)和1 × 青霉素-链霉素(Sigma-Aldrich,PA333)的DMEM(Gibco,41966)中生长。培养瓶(37℃,5%二氧化碳),直到细胞融合率达到约90%,然后用9毫升添加2%胎牛血清和1 × 青霉素-链霉素的混合样本代替细胞培养液。每天观察潜在的细胞病变效应(CPE)。用RT-PCR法测定病毒载量的增加,用每个T-25瓶在感染后0(基线)、24和120h的培养上清液100tμl测定病毒载量的增加。在BSL-2实验室中,DMEM暴露于空气中24小时(见“液体样本”一节),未暴露的DMEM和添加SARS-CoV-2合成寡核苷酸控制序列的DMEM分别作为阴性对照和阳性对照(Supp1。表1)。接种11天后,将混合样本的上清液(1毫升)一次性送入接种有Vero E6细胞的新培养瓶中,其中含有4毫升的细胞培养基。传代两天后,如上所述采集样本,用RRT-PCR进行定量。所有涉及活病毒的程序都在BSL-3实验室进行。
瑞典伦理审查机构DNR2020-01787批准获取患者信息。由于道德委员会认为这种回溯性数据收集是完全匿名的,瑞典伦理审查机构放弃了征得患者同意的需要。这项研究是根据良好的临床和科学实践进行的,并遵循《赫尔辛基宣言》的伦理原则。
在2020年4月17日和28日连续进行的两轮表面采样中,19个通风口中有7个(36.8%)同时检测到SARS-CoV-2 N和E基因RNA,而11天后,4个通风口(21%)同时检测到这两个基因。CT值在33.77至39.78之间(表2),序列经Sanger测序证实。所有三个来自病房天花板的混合细胞培养液样本都对这两种基因都呈阳性;ct值在33.41到36.64之间。池1(7个房间的液体捕捉器,由确诊的新冠肺炎患者占用)N基因35.47和E基因36.4,池2(6个疑似Covi
在这项研究中,我们在收容新冠肺炎病人的病房的通风口中发现了SARS-CoV-2RNA。在放置在悬挂在通风口下方的敞开的碟子里的液体中也检测到病毒RNA。在被调查的三个新冠肺炎病房的排气过滤器和开放式培养皿中,也检测到了类似水平的病毒RNA,细胞培养基至少为44到56微米。只对每个过滤器的一小部分进行了分析,这意味着从新冠肺炎病房发出的大量颗粒物可以扩散到比液滴传输路径所能解释的更远的距离。在之前的研究中,通风效果没有显示出对飞沫传播疾病传播风险的任何明显影响,这可能是因为飞沫更多地受到重力的影响35。此外,被调查的医院大楼的通风系统的空气流量相对较低;每个房间每小时的总换气量在1.7到3次之间,具体取决于房间的体积。在大多数指南35中,空气传播感染隔离室的建议是12ACH。值得注意的是,调查环境中的空气相对湿度很低,在30%到31%之间。最近有人建议,空气湿度低会增加SARS-CoV-2在空气中传播的风险36,37。
我们通过对大量的表面和过滤样品进行RRT-PCR,启动了这项研究。据报道,在10、15、38年前,已在通风口检测到SARS-CoV-2以及其他冠状病毒RNA。然而,在病人护理区域超过50米的排气过滤器中检测到病毒RNA是意想不到的。针对这些发现,我们发现迅速解决感染力问题是至关重要的,以便确定未感染患者、被调查病房的工作人员以及在使用通风系统时可能暴露的服务人员的直接感染风险。因此,我们采用了上述特别方法,试图确定样本的感染力。我们知道,在液体捕捉器中采用的采样方法有几个潜在的局限性:病毒颗粒在重力作用下沉积在液体中的可能性,病毒颗粒保持感染能力、浓度和增量的时间长度。
.