COVID的大型研究发现雷米希韦不起作用-FDA无论如何都会批准
周四,美国食品和药物管理局(FDA)全面批准了用于治疗新冠肺炎的抗病毒药物redesivir-就在几天前,一项大规模的全球研究得出结论,该药物没有任何好处。
食品和药物管理局局长斯蒂芬·哈恩在一份声明中说:“在这场史无前例的突发公共卫生事件中,食品和药物管理局致力于加快新冠肺炎治疗药物的开发和供应。”“今天的批准得到了该机构严格评估的多项临床试验数据的支持,这些数据代表着新冠肺炎大流行的一个重要科学里程碑。”
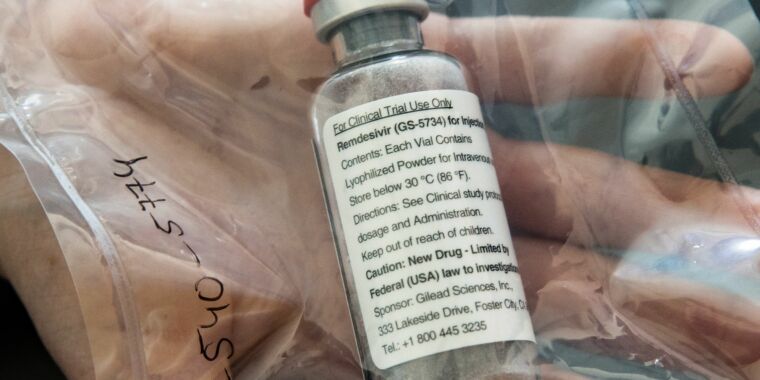
FDA是基于对redesivir的三项临床试验做出这一决定的,redesivir是一种改用的实验性抗病毒药物,名为Veklury。一项是由国家过敏和传染病研究所进行的随机、双盲、安慰剂对照试验。包括1,062名住院的新冠肺炎患者,其中541人接受了药物治疗。试验的结论是,雷米德韦将感染的中位恢复时间从15天缩短到10天。运行这项试验的研究人员将患者的“康复”定义为要么患者出院-无论患者是否仍有限制活动或需要在家中补充氧气的挥之不去的症状-要么患者仍在医院但不再需要医疗护理,比如如果他们因为感染控制的原因被留在医院。
FDA考虑的另外两项试验是由制造瑞德韦尔的吉利德公司进行的。其中一项审判调查了约600名中度病例的新冠肺炎。患者被分成三组,每组约200人-一组接受10天的瑞希韦疗程,一组接受5天的疗程,以及一组接受标准治疗。在治疗的第11天,与对照组相比,接受5天雷米德韦疗程的组的症状评分有统计学上的显著改善。然而,接受了10天疗程的瑞希韦的那一组与对照组相比没有统计上的显著改善。
吉利德的另一项试验观察了400名新冠肺炎病情严重的患者。他们被平均分成两组-一组接受了5天的redesivir疗程,另一组接受了10天的疗程。两组在康复或死亡方面没有统计学上的显著差异。
Barry Zingman在吉利德发布的一份新闻声明中说:“(FDA)批准Veklury标志着通过提供一种有效的治疗方法,帮助患者更快康复,进而帮助保存稀缺的医疗资源,从而帮助应对大流行的努力具有重要的里程碑意义。”Zingman是阿尔伯特·爱因斯坦医学院的教授,也是进行NIAID雷米德韦试验的研究人员之一。
但是FDA对瑞德韦尔的批准紧跟在该药物第四次也是最大规模试验的数据之后,而那次试验并没有显示出任何益处。这些数据来自世界卫生组织(World Health Organization)的大规模团结试验,该试验建立了一个国际试验网络,在30多个国家的500个地点招募了近1.2万名患者,测试多种重新调整用途的疗法。Remdevir最初是在十多年前开发的,作为治疗丙型肝炎和呼吸道合胞病毒(RSV)的潜在药物。它还进行了对抗埃博拉病毒的测试,但被其他治疗方法击败。
根据团结试验的初步结果-上周在线报道了该试验的计划发表在《新英格兰医学杂志》(The New England Journal Of Medicine)上-给了2743名患者雷米德韦尔,并将他们的结果与接受标准治疗的2708名患者的结果进行了比较。世卫组织发现,在这两组人中,雷米西韦并不能降低死亡率。它也没有改变有多少患者进展到需要机械通气,也没有改变患者在住院7天后出院的比例。
当团结试验的数据首次公布时,吉列德猛烈抨击了结果,说:“新出现的数据似乎与多个随机对照研究验证[redesivir]临床益处的更有力的证据不一致。”