合成生物学第二个十年:2010-2020
合成生物学是本世纪最受炒作的研究课题之一,2010年它进入了青少年时期。但是,与其说这是一个有问题的时代,不如说我们看到了合成生物学的蓬勃发展,并带来了许多新技术和里程碑式的成就。
2020年,合成生物学迎来了20岁生日。它的第一个十年见证了一些令人印象深刻的研究论文,许多有远见的思考和前所未有的兴奋,但它的第二个十年-从2010年到2020年-是真正需要用一些真正的成就来取代炒作的时候。那么它是如何做到的呢?
这十年有了一个很好的开端。回顾2010年,今年最大的合成生物学故事是J·克雷格·文特尔研究所(J.Craig Venter Institute,JCVI)的一个团队1完成了工作细菌基因组的合成。这一里程碑式的成就表明,DNA合成和DNA组装可以扩大到兆基大小,实现了本世纪初的一些最大雄心壮志。然而,仅仅扩大DNA建设并不足以实现该领域的许多其他雄心壮志。2010年,“合成生物学的五个硬真相”(Five Hard Truths For Syntheal Biology)发表,这篇评论文章探讨了工程野心的缺乏如何阻碍了实现可靠性、标准化和自动化设计承诺的努力2。这些确实是该领域面临的问题,“自然通讯”(Nature Communications)首批合成生物学论文之一也强调了这一点。这篇论文显示,当转移到不同的大肠杆菌菌株3中时,一个强大的基因逻辑门失败了。环境、噪音、负担和交叉反应等棘手的生物学问题真的能得到解决,让我们能够像布线电子电路一样设计细胞吗?
多亏了该领域许多人从事的具有挑战性的技术生物学和生物工程工作,尤其是麻省理工学院的克里斯·沃格特,答案是肯定的。2016年,尼尔森等人发表了Cello,这是一个了不起的端到端计算机辅助设计系统,用于在大肠杆菌4中构建逻辑电路。在过去十年的所有论文中,这可能是最让铁杆合成生物学家满意的,因为它实现了许诺的生物学工程,并通过标准化、特征化和自动化设计实现了这一点。在这篇论文之前的几年里,Voigt的团队不知疲倦地发表了这么多关于大肠杆菌合成生物学的其他基础论文,给我们提供了遗传部件的算法设计,以及部件库的专业特征,这并不是巧合。虽然关注合成生物学的许多具有里程碑意义的重大成就很容易(图1),但真正帮助该领域实现这一炒作的是大量艰苦的技术工作,以提高我们对基因部分的设计和理解,同时创新和发现新技术,使我们能够比以往任何时候都更好地编写、构建、编辑和共享DNA代码(图2)。
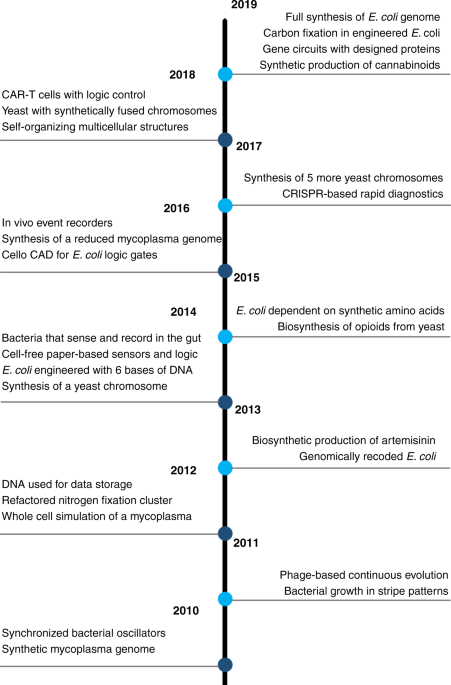
表中列出了这十年的时间表,并简要总结了每年出版的一些关键研究里程碑。
图中显示了合成生物学中使用的工程周期,并用卡通说明了一些关键技术和工作方式,这些技术和工作方式现在有助于加速周期的每个阶段。
事实上,回顾10年来,最令人震惊的是,在那些工程生活中,方法和工具发生了怎样的变化。许多团体仍然依赖于iGEM竞争来交换他们的DNA部分。这些部件只能通过BioBrick克隆进行串行组装,而且这些部件的性能数据很少可靠。构建基因构建是一项缓慢的实验室工作,通常在添加到细胞中时会导致失败。在细胞内一次固定DNA结构的方法严重缺乏,而且需求量很大。因此,合成生物学小组在2011年和2012年首次突袭CRISPR等基因编辑技术也就不足为奇了。自2006年以来,乔治·丘奇的实验室一直在进行一个项目,将大肠杆菌中的每个标签终止密码子突变为TAA,以释放一个密码子,以获得额外的氨基酸5。因此,他们对开发任何可以精确改变细胞内DNA的技术非常感兴趣,这也就不足为奇了。他的团队和他的前博士后在2013年发表了前两篇论文,显示CRISPR被用于真核细胞,并在接下来的几年里开发了CRISPR的许多进一步创新,包括基于CRISPR的基因驱动。加利福尼亚州的合成生物学小组也迅速将CRISPR转变为不仅仅是一种切割工具,发明了现在无处不在的dCas9作为DNA的可编程绑定器,以实现可定制的基因调控6。
虽然CRISPR无疑是生物科学十年来的突破,但它的前身TALENs(TAL-Effector Nucleases)在改变合成生物学在过去10年中的变化方面可能值得更多赞扬。任何DNA序列和I的模块化、可编程绑定的承诺
基因合成成本的下降在很大程度上要归功于新的方法,即在芯片上并行打印数千个寡核苷酸,形成“寡核苷酸池”,并将其与下一代测序(NGS)相结合,成为验证组装dna的一种更具成本效益的方法。这两项技术还为人们在合成生物学领域的工作方式打开了一扇门,突然之间,在一次实验7中并行设计、建造和测量数十万个基因设计变得经济高效。如果你能将基因设计的输出与NGS兼容的测量(例如条形码RNAseq)联系起来,那么数据分析就成为你的新瓶颈,而不是像以前那样设计和组装。这导致合成生物学中数学方法和生物学之间的关系在过去十年中发生了重大转变。在本世纪头十年,当制造和测试DNA结构缓慢且昂贵时,数学建模对于预测成败和缩小设计空间是有价值的。现在很少需要这种方法,取而代之的是数学分析在大型数据集的统计分析中找到了价值,并用它来学习如何设计DNA。
在过去10年中,高功率计算还开辟了可以建模和预测的新领域。在大卫·贝克(David Baker)团队的带领下,蛋白质的合理设计突飞猛进,结束了这十年,成为活酵母细胞基因电路的一部分8。有史以来第一个完整的细胞模型--生殖支原体模型发布,能够模拟数百个基因在一个细胞周期9中的影响。这有助于JCVI的最小基因组项目。2016年,JCVI令人印象深刻地设计出了一种合成基因组10最小化的细菌,这进一步奠定了一个里程碑。
合成基因组学也进入了真核细胞,国际Sc2.0联盟构建了经过高度修饰但功能齐全的贝克酵母第11号染色体的合成版本。大肠杆菌也以合成基因组结束了这十年,重新设计和构建的基因组去掉了遗传密码12的64个密码子中的3个。这样的重新编码使细胞能够根据需要容易地将非标准氨基酸插入蛋白质中。这是由教会实验室基于突变的方法首创的,该方法在本世纪初将大肠杆菌的使用减少到只使用63个密码子,证明了遗传密码5的扩展。在大肠杆菌中,这种密码的扩展也是通过增加DNA碱基来实现的,而不仅仅是A、T、C和G碱基。
DNA也成为了一种存储数据的方式,最初只是通过化学合成在体外存储数据,然后也通过“分子记录器”基因系统在细胞生长、分裂和改变基因表达时使用重组酶或CRISPR来修改DNA。细胞中的感应和记录甚至进入了人体,肠道细菌也感应和报告了老鼠体内的事件。基因工程益生菌被制造出来,可以检测尿液中的癌症,而其他细菌则将它们转化为治疗方法,纠正新陈代谢紊乱,感知和摧毁病原体。制药业最热门的基于细胞的疗法,针对癌症的CAR-T细胞,也开始配备合成生物学的传感和逻辑设备。合成生物学的传感和逻辑还发现了更多的医疗应用,包括纸基生物传感器,可以快速设计成检测埃博拉和寨卡病毒13等病原体的RNA。这些传感器和其他最近的应用一样,通过新的模块化方法来设计复杂的核酸相互作用,如脚趾开关,以及通过一种新的“无细胞”方法来进行合成生物学研究,使用细胞裂解物作为细胞内工程14的可定制和可访问的替代方案。
医疗保健现在可以说已经取代代谢工程成为合成生物学应用的首选,但这也没有阻止这一领域的进展。学术成就包括设计细胞来固定二氧化碳和氮,以及让酵母制造类阿片和大麻素。许多研究所已经建立了生物实验室,它们可以展示细胞的快速工程,以用于数十种不同分子的生物合成15。当然,利用合成生物学进行代谢工程的大部分工作现在都在像Amyris、Genomatica、Ginkgo和Zymergen这样的公司进行。
回顾这十年,合成生物学的许多研究里程碑和新方向确实令人印象深刻,但作为合成生物学研究人员,最令我们兴奋的是使能技术的进步,因为这些进步揭开了未来的序幕。然而,如果我们要寻找十年来最大的成就,证明2010年该领域的炒作是合理的,那么我们只能看到世界各地数百家合成生物公司的激增和估值。现在存在着一个价值数十亿美元的行业,生产化学品、药物、蛋白质、探针
5.Lajoie,M.J.等人。基因重新编码的生物体扩展了生物功能。科学342,357-360(2013)。
6.齐,L.S.等人。将CRISPR重新定位为RNA引导的平台,用于基因表达的序列特异性控制。152号,1173-1183号(2013)。
7.Cambray,G.,Guimaraes,J.C.&;Arkin,A.P.对244,000条合成序列的评估揭示了在大肠杆菌中优化翻译的设计原则。纳特。生物技术。36,1005-1015(2018)。
8.Ng,A.H.等人。使用从头蛋白开关的模块化和可调生物反馈控制。自然572,265-269(2019年)。
9.Karr,J.R.等人。全细胞计算模型根据基因型预测表型。电话150,389-401(2012)。
10.Hutchison,C.A.3.等人。最小细菌基因组的设计和合成。科学351,公元6253(2016)。
11.Richardson,S.M.等人。一种合成酵母基因组的设计。科学355,1040-1044(2017)。
12.Fredens,J.等人。具有重新编码基因组的大肠杆菌的全合成。自然569,514-518(2019年)。
14.Tinafar,A.,Jaenes,K.&;Pardee,K.合成生物学无细胞。BMC Biol 17,64(2019年)。
15.Casini,A.等人。90天内制造10个分子的压力测试:生物工程方法的外部评估。杰姆。化学。SoC。140、4302-4316(2018)。
我们要感谢每一位在2020年7月参与Twitter讨论的人,他们讨论了过去10年来合成生物学最重要的成就,这些成就帮助形成了这篇文章。此处有指向此对话的链接:https://twitter.com/ProfTomEllis/status/1280982288797446144.。
开放访问本文按照知识共享署名4.0国际许可进行许可,该许可允许以任何媒介或格式使用、共享、改编、分发和复制,只要您对原始作者和来源给予适当的信任,提供到知识共享许可的链接,并指明是否进行了更改。本文中的图片或其他第三方材料包括在文章的CreativeCommonsLicense中,除非在材料的信用额度中另有说明。如果材料未包含在文章的“知识共享许可”中,并且您的预期用途未得到法定法规的允许或超出了允许的用途,则您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.。
提交评论即表示您同意遵守我们的条款和社区指南。如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。