Remdesivir是如何工作的,为什么它不是终极冠状病毒杀手
抗病毒药物雷米德韦尔已被批准在住院的新冠肺炎患者中紧急使用,在最近的研究中,它显示出作为治疗这种大流行性疾病的希望。
带着对病毒学家简·卡雷特,博士,遗传学家朱迪思·弗莱德曼,博士和传染病专家鲍勃·谢弗,医学博士的帽子提示,让';s跟踪冠状病毒下游,因为它在感染细胞内通过其议程。
接近尾声时,我们将聚焦于该病毒的几个致命弱点之一,我们将看看remdesivir如何能提供帮助--唉,为什么它自己可能不能拯救这一天呢?
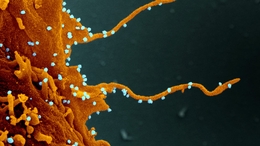
在此之前,我跟踪了新型冠状病毒对敏感细胞的入侵。当我们离开的时候,SARS-CoV-2已经像一只小个子水生生物一样骑马进入细胞,悄悄地藏在一个被膜包裹的小气泡里,称为内体。
在内体内,病毒仍然包裹在自己的膜外套或包膜中,当病毒进展顺利时,它会与周围的内体膜融合。病毒包膜的内容物溢出到周围(相对)广阔的细胞海洋或胞浆中,占据了细胞细胞核和外膜之间的空间。
这些内容中最主要的是病毒的基因组,它从自己强加的牢狱中爬出来,追求自己的命运:它渴望产生数千个相同的后代,这些后代最终会从细胞的围膜中冒出来,散开感染更多的细胞。
那条孤独的RNA单链,也就是病毒的基因组,有很大的工作要做--事实上,弗莱德曼和卡雷特告诉我有两条-为了引导自己养育一群后代。首先,它必须整体和大量地复制自己,每个拷贝都是新病毒颗粒的潜在种子。另一方面,它必须产生自身的多个部分拷贝--切割下来的片段,作为指令指南,告诉细胞的蛋白质制造机器(称为核糖体)如何制造病毒的二十多种蛋白质。
要做到这两点,病毒需要自己的一种特殊的聚合酶:一种充当遗传物质复制机的蛋白质。每个活着的细胞都使用聚合酶来复制其基于DNA的基因组,并将沿该基因组的驻留基因转录成核糖体可以阅读的基于RNA的指令。
与我们的不同,SARS-CoV2基因组是由RNA组成的,所以它对核糖体是友好的;但是要自我复制就意味着要制作RNA的RNA副本。我们的细胞从来不需要这样做,而且它们缺乏能够做到这一点的聚合酶。
然而,SARS-CoV2的基因组确实携带了RNA到RNA聚合酶的编码基因。如果唯一RNA链能够找到并锁住核糖体,那么核糖体就可以将病毒聚合酶的基因蓝图转化为工作的聚合酶。对病毒来说幸运的是,单个细胞中可能有多达1000万个核糖体。
一旦制造出来,病毒聚合酶就开始发挥作用,不仅产生全长病毒基因组的多个拷贝--复制--而且还产生代表单个或一组病毒基因的较小片段。这些较小的片段可以爬上核糖体,并命令它们产生组装无数新病毒后代所需的所有蛋白质。
值得注意的是,这些新产生的蛋白质包括更多的聚合酶分子。SARS-CoV-2基因组的每个拷贝都可以通过多聚合酶分子重复馈送,产生无数忠实的初始RNA链复制。
嗯,大部分都是忠实的。Carette和Frydman告诉我,我们都会犯错,病毒聚合酶也不例外;实际上,就聚合酶而言,它相当马虎--比我们自己的细胞聚合酶还要草率得多。因此,最初病毒基因组的拷贝--以及它们的拷贝--面临着充满拷贝错误的风险,也就是突变。
然而,冠状病毒聚合酶,包括SARS冠状病毒聚合酶,独一无二地配备了一种辅助校对蛋白,可以捕捉到大多数这些错误。它剔除了错误插入的化学成分,并给聚合酶另一次通常成功的尝试,将适当的化学单位插入到不断增长的RNA序列中。
这就是雷米德韦尔可能变得重要的地方。它属于一类通过伪装成DNA或RNA序列的合法化学构件来发挥作用的抗病毒药物。这些装腔作势的人把自己缝在新生的一条链上,把东西粘得很烂,以至于聚合酶停滞不前或产生了有缺陷的产品。Shafer说,Remdesivir的优点是不会弄乱我们的细胞和自己的聚合酶,他维护着一个持续更新的针对SARS-CoV-2的药物试验结果的数据库。
弗莱德曼告诉我,现在这种病毒正在制造大量腐烂的基因组,这些基因组毒害了病毒的复制过程。如果它的后代是有缺陷的,不能突破并侵入全身的其他细胞,病毒的使命就失败了--病人就会好转。
但是,谢弗说,尽管瑞德韦尔在伪装病毒聚合酶的校对蛋白方面相当不错--至少比许多其他抗病毒药物要好--但它还远未达到完美。一些完整的病毒基因组拷贝仍然可能设法制造出来,逃离细胞,并感染其他细胞--任务完成了。
与单独使用redesivir相比,将redesivir与一些仍在寻找的、尚未发现的可能阻止校对者的药物联合使用,可能会被证明是一种更可靠的策略。
除此之外,SARS-CoV-2最致命的方面很可能是我们自身对它的免疫反应。
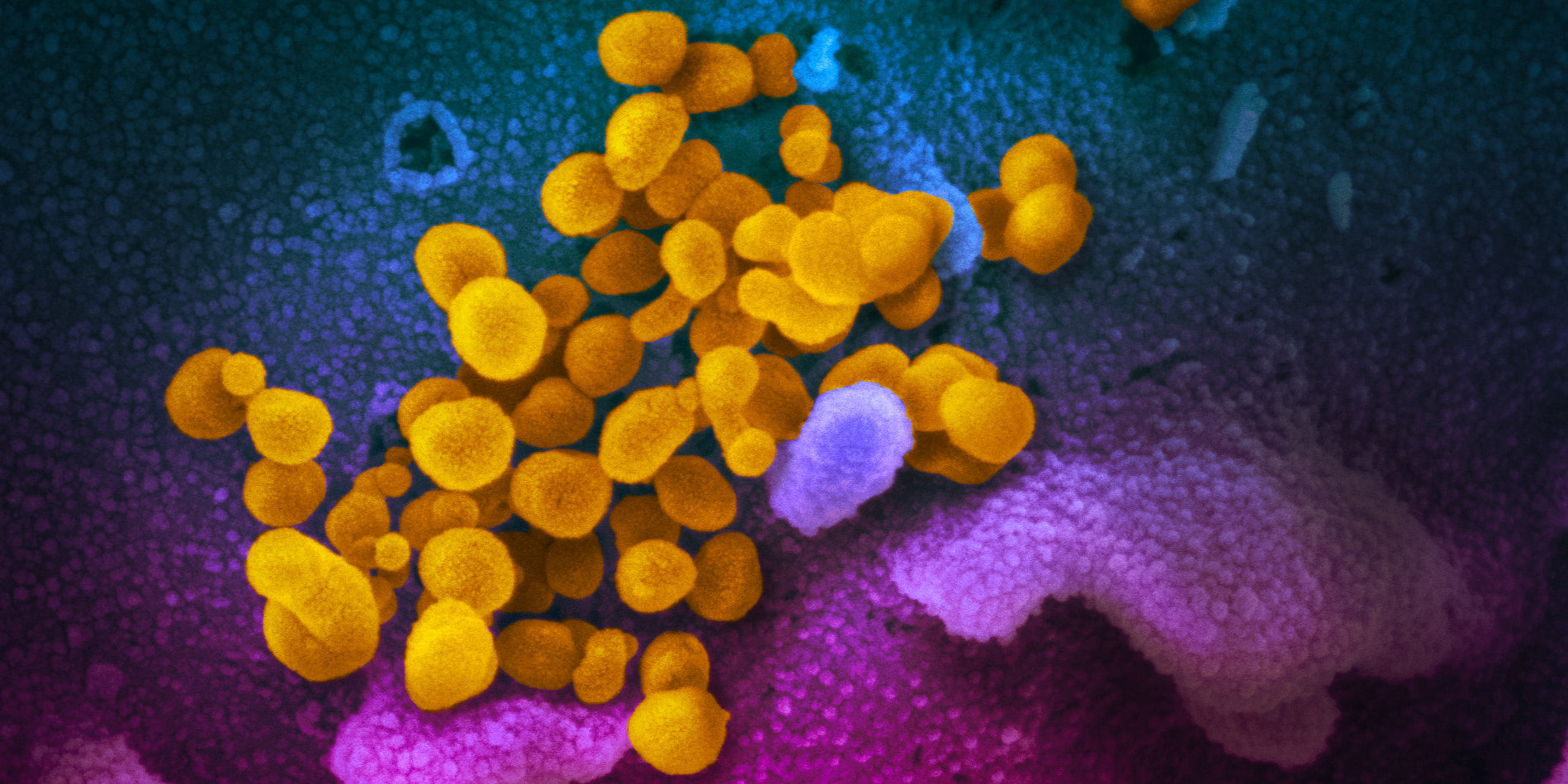
从实验室培养的细胞表面出现的SARS-CoV-2图像,由国家过敏和传染病研究所-美国国立卫生研究院落基山实验室提供