谷氨酸的变化与裸盖菇素对自我溶解的体验
人们越来越感兴趣的是迷幻物质,如裸盖菇素,对抑郁症等以自我体验扭曲为特征的疾病的治疗作用。临床前证据的积累强调了谷氨酸系统在药物对大脑和行为的急性作用中的作用;然而,这一点从未在人类身上进行过测试。按照双盲、安慰剂对照、平行分组设计,我们利用超高场多模式脑成像方法,证明裸盖菇素(0.17 mg/kg)诱导谷氨酸的区域依赖性改变,这预示着一个人的自我主观体验(自我溶解)的扭曲。内侧前额叶皮质谷氨酸水平较高与消极体验的自我溶解有关,而海马谷氨酸水平较低则与积极体验的自我溶解相关。这些发现为迷幻状态和基线状态的潜在神经生物学机制提供了进一步的洞察力。重要的是,它们还可能为正在进行的临床试验中证明的治疗效果提供神经化学基础。
迷幻剂是一类精神活性物质,它会引起意识状态的深刻改变,包括自我主观体验的短暂和剂量依赖性扭曲[1]。这种现象被称为自我消解[2],其特征是定义正常觉醒意识的自我参照意识的减少,最终打破了自我世界的界限,增加了与他人和周围环境的统一感[3]。重要的是,人们对使用这些物质治疗以自我体验扭曲为特征的各种精神疾病重新产生了兴趣[4,5]。最近的临床研究表明,这些物质可以增加幸福感[4,6,7,8,9,10,11],并为那些焦虑、抑郁和上瘾的人提供治疗缓解[4,9,12,13,14,15]。
越来越多的证据表明,经典的迷幻剂,如麦角酸二乙酰胺(LSD)、裸盖菇素和二甲基色胺(DMT),可以刺激位于皮质锥体神经元上的5-HT2A受体,这是其致幻作用的主要作用机制[16,17,18,19,20,21,22]。然而,来自临床前研究的越来越多的证据也强调了谷氨酸系统在5-HT2A受体介导的对大脑功能和行为的影响中的作用[19,23,24]和[17]。具体地说,5-HT2A受体的激活导致前额叶皮质锥体神经元活动的谷氨酸依赖性增加[18,19,25,26],随后调节前额叶网络活动[16]。此外,细胞外谷氨酸的增加被认为激活了位于相同神经元上的AMPA受体,增加了脑源性神经营养因子(BDNF)的表达[16,27,28],这是一种与神经元生存和生长有关的蛋白质,在病理人群中表达减少[29]。综上所述,有人认为5-HT2A受体介导的谷氨酸释放是迷幻剂急性作用的最终共同途径,也是潜在的治疗效果的潜在机制[16]。然而,还没有研究调查迷幻剂对人类大脑谷氨酸水平的急性影响,以及它与迷幻诱导的大脑功能和行为改变的关系。
本研究旨在通过使用超高场质子磁共振波谱(MRS)来确定谷氨酸对迷幻状态的贡献,该波谱可以在体内评估指定脑区的谷氨酸。首先,我们评估了经典迷幻剂裸盖菇素对人脑中谷氨酸浓度水平的急性影响。然后,我们评估谷氨酸水平与迷幻状态的关键特征之间的关联,例如自我解体的体验,以及静息状态网络(RSN)功能连接(FC)的中断。已经反复发现,LSD、DMT和psilocybin降低了几个RSN中的网络内连通性,同时增加了这些网络上的连通性[30、31、32、33、34、35、36]。受影响的RSN包括默认模式网络(DMN),这是一组相互连接的脑结构,包括内侧前额叶(MPFC)、后扣带回和顶下小叶[37,38]。重要的是,DMN已经变得与自我参照心理活动密切相关[37,39],迷幻诱导的DMN功能改变被反复地牵连在自我溶解的经历中[33,40,41,42]。
mPFC和海马中的相对谷氨酸浓度被量化。这些区域是根据先前的解剖、功能选择的
本研究是根据“赫尔辛基宣言”(1964年)制定并于2013年10月在巴西福塔莱萨修订的人体实验伦理准则,并根据“涉及人体的医学研究法案”(WMO)进行的,并得到了学术医院和大学医学伦理委员会的批准。所有参与者都被充分告知了所有程序、可能的不良反应、法律权利和责任、预期利益以及他们自愿终止而不产生后果的权利。
受试者在主观药物作用高峰期间接受结构磁共振成像(治疗后50 分钟)、mPFC单体素质子磁共振波谱(65 分钟后)和海马区单体素质子磁共振波谱(95 分钟后),以及功能磁共振成像(102 分钟后)。图像采集在Magnetom 7T磁共振扫描仪上。
光谱体素由训练有素的操作员放置在mPFC(体素大小=25 × 20 × 17 mm3)和右侧海马(体素大小 = 37 × 15 × 15 mm3)。频谱采集采用模拟回波采集模式[51]序列(TE = 6.0 ms,TR = 5.0 s,64个平均值)。MRS的结果测量指标是谷氨酸、γ-氨基丁酸、萘乙酸和mI与总肌酸(肌酸 + 磷酸肌酸)的浓度比率,因为使用肌酸磷酸肌酸作为内部参考可以固有地校正由发射或接收射频不均匀性、磁场漂移和体素中包含的脑脊液引起的变异性[52]。
静息采集2 5 8个全脑EPI体积值(TR = 14 0 0 ms;TE = 2 1 ms;视野=198 mm;翻转角 = 6 0°;倾斜采集方向;交错层厚采集;72层;层厚 = 1.5 mm;体素大小 = 1.5 × 1.5 × 1.5 mm)。在扫描过程中,参与者被展示了一个白色背景上的黑色十字架,并被指示专注于这个十字架,同时清理他们的大脑,尽可能地静止不动。
使用CONN工具箱18.b[53]处理和分析静息状态数据。所有容积重新排列,去翘曲,分割成灰质、白质和脑脊液,归一化到一个标准的立体定向空间(蒙特利尔神经研究所),并在半最大高斯核下以6 mm的全宽进行平滑。
独立分量分析(ICA)使用在CONN工具箱中按照前面描述的方法实现的分组ICA过程来执行[54]。独立成分被限制在20个,以便与10个已建立的RSN[55]以及之前关于裸盖菇素[42]和LSD[32,33]的研究进行比较。
用意识改变5个维度量表[50]和自我消解问卷[1]在用药后360min进行 评分,作为药物疗效的回顾性测量。
在给药后(80min、150min和360min)采集静脉血样,以评估裸盖菇素的主要代谢物裸盖菇素的浓度。
在IBM SPSS Statistics 24中使用非参数Mann-Whitney U检验对代谢物浓度水平和问卷回答进行统计分析。
对于网络内功能障碍的评估,比较了安慰剂和药物条件下未阈值、二值化的ICA成分图像(两样本t检验)。使用参数统计(体素阈值p <; 0.001未校正,簇阈值p <; 0.05簇大小,错误发现率校正,双侧)。
对于网络间FC的评估,从ICA分析中获得的RSN的无阈值二值化地图被导入为感兴趣区,并提取时间序列的加权和。然后使用双变量相关性比较两种情况下所有RSN之间的时间进程。结果的相关系数在安慰剂和药物条件之间进行了比较(两样本t检验)。使用FDR对多次比较的结果进行校正。
通过典型相关[56]来评估裸盖菇素诱导的(I)mPFC和海马中的相对谷氨酸浓度水平,(Ii)自我溶解的等级,包括5D-ASC(海洋无界和焦虑的自我溶解)的两个维度和EDI上的分数,以及(Iii)网络内静息状态FC之间的关联,使用提取的连接强度(β)值。变量分为两组,第一组包括生物变量作为预测因子[(I)和(III)],第二组包括主观变量作为标准(II)。在适用的情况下,执行迭代补偿方法来填充缺失的数据点。
所有测试的显著性的α标准假设为p <; 0.05.。
裸盖菇素组(n = 30)和安慰剂组(n = 30)在人口统计学变量方面没有不同(表3S1)。
平均值(S.E.)。血清中psilocin的浓度如表2所示。给药后80 min血药浓度达到峰值(15.6 1 ± 1.6 6 ng/mL),随后开始下降(4.85 ± 0.5 4 ng/mL,36 0 min)。测量的浓度与应用的口服剂量一致[57]。
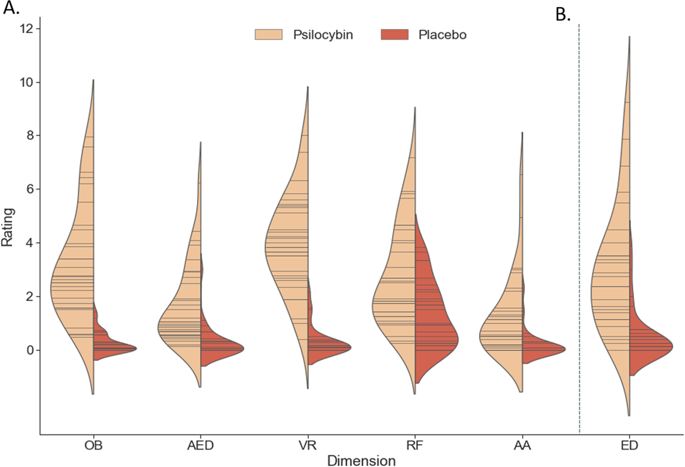
裸盖菇素的给药与5D-ASC的所有(子)维度(U = 13.5225;p ≤ 0.001 Effect Size = 0.43-0.84,图1a;S1)和电子数据交换(U = 91.5,p <; 0.001,Effect Size = 0.67,图1b)上的评级增加相关。
小提琴曲线图显示每个治疗组在5D-ASC的5个主要维度上的报告分数(A)、自我溶解问卷的评分(B)。小提琴中的每根木棒都表示一个数据点,而密度则按比例缩放为所有木箱中的相对计数。
表1中报告了每个处理条件的光谱质量。不符合数据质量标准检查的数据点概览可在表1S6中找到。
根据假设,裸盖菇素后mPFC中的谷氨酸/总肌酸(谷氨酸)比安慰剂高(平均 ± S.E.;裸盖菇素:1.23 ± 0.02;安慰剂:1.14 ± 0.02,U = 200.50,p = 0.01,Effect Size = 0.80,图2a)。
mPFC中有a-谷氨酸,mPFC中有b-NAA,海马中有c-谷氨酸,mPFC中有d-GABA。该图由概率密度图、盒图和原始数据点组成。在方框图中,分隔方框的线表示数据的中位数,末端表示上/下四分位数,极值线表示排除异常值的最高和最低值。雨云图可视化的代码改编自Allen等人。[99][font=宋体]。
此外,tNAA/总肌酸(裸盖菇素:1.4 ± 0.03;安慰剂:1.31 ± 0.02,U = 210.0,p = 0.02,效应尺寸 = 0.72,图2b)和γ-氨基丁酸/总肌酸(裸盖菇素:0.17 ± 0.01;安慰剂:0.14 ± 0.0 1,U = 6 6.0,p = 0.0 1,效应量 = 0.99,图2 d)均高于安慰剂组。
相比之下,裸盖菇素治疗后海马中的谷氨酸(裸盖菇素:0.77 ± 0.03;安慰剂:0.88 ± 0.03,U = 163.50,p = 0.03,效应大小 = 0.69,图2c)比安慰剂低。
在GABA、tNAA、mI或总肌酸浓度方面,各组之间没有其他显著差异。所有研究的代谢物浓度、光谱中获得的其他代谢物的平均值参见表S3,代表性光谱和体素位置参见图S2。
在质量控制后,最终样本由裸盖菇素组的22名参与者和安慰剂组的26名参与者组成。在头部运动参数方面,各组之间没有显著差异。有关组之间的排除标准和评估的差异,请参阅补充。
在我们的分析中确定的大多数组分与Smith等人提供的模板之间有很好的一致性。[55][font=宋体]。视觉网络1-3(r = 0.80,r = 0.73和r = 0.6 4),小脑网络(r = 0.38),听觉网络(r = 0.43),执行控制网络(r = 0.5 8),额顶网络1(r = 0.5 0)和2(r = 0.47)。相反,我们不能将单个成分分配给DMN和感觉运动网络,因为这些网络被分成几个子成分,正如在多项研究中已经观察到的那样[58,59,60]。感觉运动网络由3个成分组成(躯体感觉网络:R = 0.4 0,外侧运动网络:R = 0.32,内侧运动网络:R = 0.2 4)。前侧隔核由R = 0.34和R = 0.5 2组成,感觉运动网络由3个部分组成(躯体感觉网络:R = 0.4 0,外侧运动网络:R = 0.32,内侧运动网络:R = 0.2 4)。为了能够进行全面的探索,我们决定在进一步的分析中包括所有这些组成部分。为此,根据通用术语[60]来标记各个子组件,但与以前的工作[55]不同(即,组件被标记为前部和后部DMN、内侧和外侧运动网络以及躯体感觉网络)。其余7个组件反映的是与此分析无关的噪音或网络。
在各自的网络中,与安慰剂相比,在药物条件下,在视觉网络1和2中发现的协同激活明显较少,视觉网络1和2都是DMN(前部和后部)的亚成分,以及听觉网络(图3;表S4)。
每组(安慰剂和裸盖菇素)在网络内功能连通性方面表现出显著差异的静息状态网络。
与安慰剂相比,裸盖菇素组网络间FC的广泛增加被观察到。除侧方运动网络外,所有被调查的网络均受到不同程度的影响(表S5)。
将这四个生物变量作为三个自我溶解变量的预测因子,进行典型相关分析,评价两个变量集之间的多元共享关系。分析得到三个函数,每个连续函数的平方典型相关系数(Rc2)分别为0.363、0.282和0.253。所有功能的完整模型具有统计学意义(F(12,61.14) = 2.47,p = 0.008),可解释65.9%的方差。
考虑到每个函数的Rc2效应,前两个函数是显著的(分别为p = 0.008和p = 0.016),在本研究中被认为是值得注意的,函数1解释了36.3%的方差,函数2解释了28.2%的方差。
表2中给出了函数1和2的标准化正则函数系数、结构系数(Rs)和平方结构系数(Rs 2),以及每个变量的两个函数之间的共同性(H2)。功能1表明,焦虑自我消解(AED)是主要贡献因素,海洋无界(OB)是次要贡献。在预测因子方面,mPFC谷氨酸是主要的预测因子,前部DMN FC起次要作用。这些结果表明,消极经历的自我解体(即AED)的最强预测因子是mPFC谷氨酸的增加。
功能2表明,主要贡献者是EDI的评级,OB是次要贡献者。对于预测因子而言,海马谷氨酸是最强的预测因子,后脑DMN Fc的贡献次之。这些结果表明,积极体验的自我溶解的最强预测因子是海马谷氨酸的减少。
本研究首次尝试评估裸盖菇素对人脑关键区域谷氨酸水平的急性影响,这可能在5-羟色胺能迷幻剂的作用中起主要作用。使用超高场多模式MRI方法,我们证明了与安慰剂相比,裸盖菇素诱导的神经代谢物浓度的区域依赖性改变。具体地说,接受裸盖菇素治疗的参与者在mPFC中表现出较高的相对谷氨酸浓度水平,而在海马中表现出较低的相对谷氨酸浓度水平。分析表明,谷氨酸的区域依赖性变化也与自我溶解的不同维度相关。而mPFC谷氨酸的变化被发现是消极体验自我消解的最强预测因子,而海马谷氨酸的变化被发现是正向体验自我消解的最强预测因子。
先前的研究表明,mPFC富含主要位于V层锥体神经元的5-HT2A受体[61],并调节皮层回路中的兴奋性传递[43,62,63]。临床前研究已经证明,通过5-羟色胺能迷幻药激活这些受体会通过增加谷氨酸释放而导致主要的兴奋性反应[18,64],这在本研究中首次在人类中观察到。这一区域谷氨酸能的增加也与h一致。
..