一种酶能在10小时内分解90%的塑料
目前的估计表明,在全球每年生产的3.59亿吨塑料中,有11.5亿-2亿吨积累在垃圾填埋场或自然环境中2.聚对苯二甲酸乙二酯(PET)是最丰富的聚酯塑料,全世界每年生产近7000万吨用于纺织品和包装3.PET的主要回收工艺通过热机械手段导致机械性能的损失4.因此,首选从头合成,PET废物继续积累。PET是一种极难水解的聚酯,具有很高的芳香族对苯二甲酸酯单元比率(这降低了链的流动性)。已经报道了几种PET水解酶,但生产率有限6,7。在这里,我们描述了一种改进的PET水解酶,它在10个小时内最终实现了至少90%的PET解聚为单体,生产率为每升每升16.7克对苯二甲酸盐(每公斤PET悬浮液200微克,酶浓度为每克3毫克)。在这里,我们描述了一种改进的PET水解酶,它最终在10个小时内至少实现了90%的PET解聚为单体,生产率为每升16.7克(每公斤PET悬浮液200微克,酶浓度为每克3毫克。这种高效、优化的酶的性能超过了迄今报道的所有PET水解酶,包括来自Ideonella sakaiensis菌株201-F6的酶8、9(甚至在辅酶10的辅助下)以及最近引起人们兴趣的相关改良变异体11、12、13、14。我们还表明,生物回收PET表现出与石化PET相同的特性,可以从酶解聚的PET废料中生产出来,然后再加工成瓶子,从而为循环PET经济的概念做出贡献。
作者声明,所有支持本研究结果的数据均可在文章、其扩展数据、其源数据中获得,或在合理要求下从相应作者处获得。所报道结构的原子坐标和结构因子已保存在蛋白质数据库中,登录号分别为LCC-S165A的6THS和ICCG-S165A的6THT。
1.塑料欧洲。塑料-2019年的事实。欧洲塑料生产、需求和废物数据分析。塑料欧洲https://www.plasticseurope.org/application/files/1115/7236/4388/FINAL_web_version_Plastics_the_facts2019_14102019.pdf(2019年)。
2.Geyer,R.,Jambeck,J.R.&Amp;Law,K.L.所有曾经制造过的塑料的生产、使用和命运。SCI。Adv.3,e1700782(2017)。
4.Ragaert,K.,Delva,L.&;Van geem,K.固体塑料废物的机械和化学回收。废品马纳格。69,24-58(2017)。
5.Marten,E.,Müller,R.-J.&;Deckwer,W.-D.聚酯的酶水解研究。二、脂肪族-芳香族共聚酯。波姆。降级。斯塔比尔。88,371-381(2005)。
6.魏,R&Amp;Zimmermann,W.用于回收顽固的石油基塑料的微生物酶:我们还有多远?微球。生物技术。10、1308-1322(2017)。
7.Kawai,F.,Kawabata,T.&;Oda,M.目前关于酶降解PET的知识及其可能应用于废流管理和其他领域。APPL。微生物。生物技术。103、4253-4268(2019年)。
8.吉田(Yoshida,S.)等人。一种降解和同化聚对苯二甲酸乙二酯的细菌。科学351,1196-1199(2016)。
10.Palm,G.J.等人。降解塑料的坂海Ideonella sakaiensis MHETase与底物结合的结构。纳特。交警。10-1717(2019)。
11.韩、X等人。PET水解酶催化机理的结构洞察。纳特。交警。82106(2017)。
12.Joo,S.等人。聚对苯二甲酸乙二酯降解分子机理的结构洞察。纳特。交警。9382(2018年)。
13.奥斯汀,惠普等人。一种降解塑料的芳香族聚酯酶的特性及工程设计。程序。纳特·阿卡德。SCI。美国115,E4350-E4357(2018)。
14.Taniguchi,I.等人。聚对苯二甲酸乙二酯的生物降解:现状及应用前景。卡塔。9、4089-4105(2019年)。
15.Brueckner,T.,Eberl,A.,Heumann,S.,Rabe,M.&;Guebitz,G.M.聚对苯二甲酸乙二醇酯织物的酶水解和化学水解。J.Polym.。SCI。A 46,6435-6443(2008)。
16.Vertommen,M.A.,Nierstrasz,V.A.,van der Veer,M.&;Warmoeskerken,M.聚对苯二甲酸乙二酯的酶法表面改性。J.生物技术。120,376-386(2005)。
17.魏,R.等人。聚对苯二甲酸乙二醇酯消费后包装的生物催化降解效率由其聚合物微结构决定。高级科学。6、1900491(2019年)。
18.Ronkvist,A.S.M.,Xie,W.,Lu,W.&Amp;Gross,R.A.Cutinase催化的聚对苯二甲酸乙二醇酯的水解。大分子42,5128-5138(2009)。
19.Zimmermann,W.&;Billig,S.用于聚对苯二甲酸乙二酯的生物功能化的酶。生化上将。英。生物技术。125,97-120(2010)。
20.Kitadokoro,K.等人。白热双歧AHK119角质酶Est119的晶体结构能在1.76µ分辨率下降解改性的聚对苯二甲酸乙二醇酯。波姆。降级。斯塔比尔。97,771-775(2012)。
21.。陈松,苏力,陈建安;吴安平,J。角质酶的性质、制备及应用。生物技术。Adv.31,1754-1767(2013)。
22.。魏,R,Oeser,T.&;Zimmermann,W.从嗜热放线菌中合成聚酯水解酶。高级应用程序。微生物。89,267-305(2014)。
23.。然后,J.et al.。Ca2+、Mg2+结合位点工程促进了热双歧杆菌聚酯水解酶对聚对苯二甲酸乙二酯薄膜的降解。生物技术。J.10,592-598(2015)。
24.。Kawabata,T.,Oda,M.&Amp;Kawai,F.基于三维对接结构与聚对苯二甲酸乙二酯模型化合物的角质酶样酶Cut190的突变分析。比奥斯基。比昂。124,28-35(2017)。
25.。苏莱曼,S.,You,DJ,Kanaya,E.,Koga,Y.&Amp;Kanaya,S.超基因组衍生LC角质酶的晶体结构及热力学和动力学稳定性。生物化学53,1858-1869(2014)。
26.。然后,J.et al.。聚酯水解酶的钙结合位点上的二硫键增加了它的热稳定性和对聚对苯二甲酸乙二酯的活性。2月开放生物6,425-432(2016)。
27.。Sowdhamini,R.等人。二硫化桥的立体化学模拟。通过定点突变导入蛋白质的标准。蛋白质工程。3、95-103(1989)。
28.。Awaja,F.&;Pavel,D.PET的回收利用。欧元。波姆。J.41,1453-1477(2005)。
29.。Barboza Neto,E.S.,Coelho,L.A.F.,Forte,M.M.C.,Amico,S.C.&Amp;Ferreira,C.A.通过旋转成型加工LLDPE/HDPE压力容器衬里。玛塔。决议17,236-241(2014)。
30.。Fullbrook,P.D.,“葡萄糖糖浆,科学与技术”(edds Dziedzic,S.Z.&Amp;Kearsley,M.W.)65-115(Elsevier,1984)。
31.。Gusakov,A.V.等人。纤维素酶水解高效混合纤维素酶的设计。生物技术。比昂。97,1028-1038(2007)。
32.。基于严格Aspen Plus模型的纤维素酶工业规模生产纤维素乙醇成本评估。生物处理Biosyst。英。39,133-140(2016)。
33.。Mohammad-Khah,A.&Amp;Ansari,R.活性炭:制备、表征和应用:综述文章。内部。J.CHEMTECH决议1,859-864(2014)。
35.。商家研究和咨询公司。硫酸钠:2020年世界市场展望和2029年预测。https://mcgroup.co.uk/researches/sodium-sulphate(2019年)。
36.。Müller,R.J.,Schrader,H.,Profe,J.,Dresler,K.&;Deckwer,W.-D.聚对苯二甲酸乙二酯的酶解:使用T.fusca的水解酶进行快速水解.。宏观醇。快速通讯。26,1400-1405(2005)。
37.。Sulaiman,S.等人。用元基因组学方法从叶枝堆肥中分离一种新的具有聚对苯二甲酸乙二醇酯降解活性的角质酶同系物。APPL。环境。微生物。78,1556-1562(2012)。
我们感谢图卢兹生物技术研究所(TBI)的iCEO设施,这是图卢兹综合筛选平台(PICT,IBiSA)的一部分,感谢它提供进入超高效液相色谱(UHPLC)和蛋白质纯化设备的通道;感谢图卢兹怀特生物技术公司(TWB,UMS INRAE 1337/UMS CNRS 3582)提供进入微型生物反应器的通道。我们感谢Carbios(法国圣博泽尔)、CRITT Bio-Industries(法国图卢兹)、Pivert(法国维内特)和LEITAT技术中心(西班牙巴塞罗那)为提纯对苯二甲酸以及PET和瓶子生产所做的贡献。我们还感谢药理和结构生物学研究所(IPBS,法国图卢兹)的结构生物物理小组进入结晶设施,以及ALBA(西班牙巴塞罗那)和ESRF(法国格勒诺布尔)同步加速器进行数据收集。我们还承认在Occigen(CINES,法国蒙彼利埃)和Curie(TGCC,巴黎-萨克雷,法国)超级计算机以及Région Midi-Pyrénées计算中间中心(CALMIP,法国图卢兹)上使用高性能计算资源。这项研究得到了松露资本(P.Pouletty)和一项科学研究赠款的支持(THANAPLAST项目,OSEO ISI合同编号I 1206040W)。
例如,M.D.、M.Chado和A.M.都是Carbios的员工。V.T.自2019年1月以来一直是Carbios的员工。C.M.T.、H.T.、V.T.、M.L.D.、S.D.、I.A.、S.B.和A.M.已提交专利WO2018/011284和WO2018/011281,专利名称为“新型酯酶及其用途”。H.T.,M.L.D.,S.D.,A.M.,M.D.和M.Chado已经提交了专利WO2017/198786,“降解塑料产品的工艺”,以保护这里描述的部分工作。保密协议阻止他们披露任何新提交的发明声明。所有其他作者声明没有竞争利益。
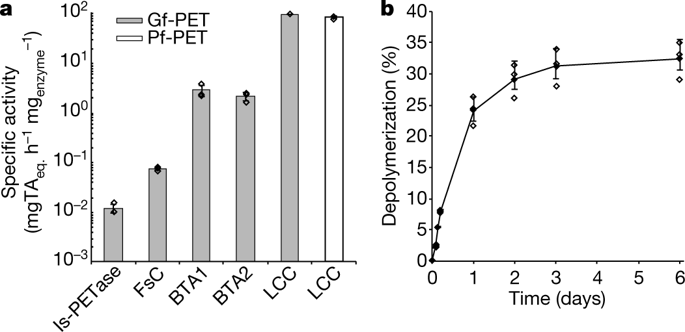
A,这里使用的酶,据报道可以水解PET 8,16,23,36,37。熔化温度(Tm)由DSF评估;数值对应于平均值C±S·D。(n=3)。B、在不同温度下,用等摩尔量的纯化的IS-PETase、FSC、BTa-水解酶1、BTa-水解酶2或LCC(6.9nmol蛋白g PET−1和2 g PET−1)水解无定形GF-PET。获得的最高具体活动为粗体。还显示了LCC对PF-PET的比活性。指的是1µs±1S.D.。(n=3)被标明;N.D.,未确定。
野生型LCC对PET的解聚不受水解产物的影响。这些图表比较了在65 °C有或没有进一步添加乙二醇(EG;根据对苯二甲酸当量的量(TA等式)计算的产率(百分比))下PF-PET的解聚动力学。在反应过程中释放的乙二醇),以及是否进一步添加TA(根据反应过程中释放的乙二醇的量计算得到的产率)。反应引发时EG或TA的加入量相当于100%PET解聚时释放出的产物量。每个符号显示平均值为1µs±1S.D.。(n=3)。LCC的热稳定性是影响PET解聚产率的一个限制因素。在65 °C(空钻石)下反应3天后,加入100g非晶态PF-PET,与野生型液晶显示器(填充钻石)的解聚动力学相比,无明显变化。然而,在65 °C下反应3天后,加入0.69nmol的野生型LCC,重新启动之前停止的分析(填充圈),其比活性与最初测定的相同(如表中所示)。每个符号代表一个平均数:±0.D。(n=3);n.a.,不适用;n.d.,未确定。
饱和结果的Boxlot分布。我们通过半纯化的方法生产了209个突变体,并在相同的PF-PET解聚条件下测定了它们相对于野生型LCC的比活性百分比。Q1和Q3分别对应于分布的第一和第三四分位数。中值显示为红线。B,比较野生型LCC和本文所用变异体的比活度和熔融温度。通过制备性生产酶,然后进行PF-PET解聚试验(见补充方法[1])进行实验。指的是1µs±1S.D.。(n=3)如图所示。
根据野生型LCC(实线)和D238C/S283C变异体(虚线)在0、1和100 mM二硫苏糖醇(DTT)存在下的DSF热变性曲线计算了一阶导数。一阶导数峰对应于蛋白质的熔融温度。每条曲线代表三重测试。随着DTT浓度的增加,二硫键减少,导致蛋白质热稳定性降低。灰色加亮表示具有0、1或2个形成的二硫键的种群。较低的DTT浓度(蓝色曲线)不足以完全减少所有的二硫键,导致具有中等熔点的蛋白质的混合群体。RFU,相对荧光单位。
在72 °C或75 °C时,温度对液晶变体F243I/D238C/S283C/Y127G解聚的影响;b,在72 °C时,液晶型变体F243I/D238C/S283C/Y127G在1 mg酶g PET−1、2 mg酶g PET−1或3下,温度对PCW-PET解聚的影响;b、温度对液晶盒变异体F243I/D238C/S283C/Y127G解聚的影响。比较了野生型LCC和变异型LCC在微型生物反应器中PCW-PET解聚的检测结果。前两列显示了PCW-PET解聚过程中使用的参数(温度和酶浓度)。接下来的四列显示了根据NaOH消耗量、EG产量、TA eq计算的解聚产率(24小时后)。生产的,或残留PET的重量。最后一列表示根据NaOH消耗计算出的反应初始速率。
在65 °C、70 °C、72 °C和75 °C条件下,聚酯纤维的结晶度水平发生了变化。
A,左侧,野生型LCC(PdB ID 4EB0;绿色)和催化无活性变体S165A(青色)重叠(在214Cα原子上的均方根偏差为0.25A)。催化残留物用洋红棒表示。右边的特写镜头集中在催化丝氨酸(S165)和邻近残基上。还示出了无偏复合省略图(灰色网格,2F o和−,Fc),在残基164-166周围在2.0σ等高线。S165A突变在结构上不影响蛋白质在该位置附近的折叠。此外,失活的酶更容易结晶并产生更高质量的晶体,因此我们将S165A突变引入到我们最有效的LCC变异体,即F243I/D238C/S283C/Y127G(ICCG)。B,野生型LCC(PdB ID 4EB0;绿色)和ICCG变异体的催化失活S165A突变体(Tan)重叠在一起(RMSD=220Cα原子上的RMSD=40.27°)。催化残基(品红)和突变残基(棕褐色)用棒表示。特写镜头显示了不同的突变及其周围的残基。与ICCG变体相比,野生型LCC的残基被表示为更细的棒。无偏合成省略贴图(灰色网格,2 F o−和F c)在1.5σ等高线显示。引入的Y127G、S165A、F243I和D238C-S283C(工程二硫桥)突变均不影响LCC的整体结构。标有星号的特写镜头显示,观察到标记为构象a和b的半胱氨酸残基的不同构象。
A,比较蛋白质骨架的灵活性,使用沿着载脂蛋白构象中酶的分子动力学模拟计算的每个残基的Cα原子的平均均方根波动。RMSF与晶体B因子(B)的链接如下:\(\text{rmsf}=\surd\Left(\frac{3B}{8{\pi}^{2}}\right)\)。红色箭头,β-链;黑色矩形,α-螺旋;黄色矩形,野生型液晶晶体结构中的环(PDBID4EB0);虚线,催化残基的位置。b,监测关键的催化原子间距离,该距离表征了在与模型底物2-HE(MHET)3的复合物中酶的分子动力学模拟过程中发生的催化事件。右侧是催化三联体(残基S165(Ser165)、H242(His 242)和D210(Asp 210))和2-HE(MHET)3的表示,突出显示了三个相关的原子间距离(d1、d2、d3)。这三张图显示了这三个距离在野生型和IC分子动力学模拟的前30秒内的分布